[2026年1月13日],药学院董长江、张郑宇团队在国际著名学术期刊《Nature Communications》上发表了题为“Structural basis of outer membrane biogenesis by the TamAB translocase”的最新研究成果。该研究利用冷冻电镜技术解析了TamAB纳米机器在不同构象下的高分辨率结构,首次揭示了其独特的“杂合桶”结构特征及磷脂转运通道,阐明了革兰氏阴性菌外膜生物发生的关键机制,为开发针对耐药菌的新型治疗药物提供了重要靶点。

革兰氏阴性细菌的外膜是其生存的关键屏障,在细菌定植、致病性以及药物耐受性方面发挥着至关重要的作用。TamAB(Translocation and assembly module A and B)纳米机器被认为是负责将磷脂转运,以及辅助关键外膜蛋白插入的重要复合物。然而,长期以来,TamAB具体的工作机制仍不为人所知,是一个亟待解决的科学难题。
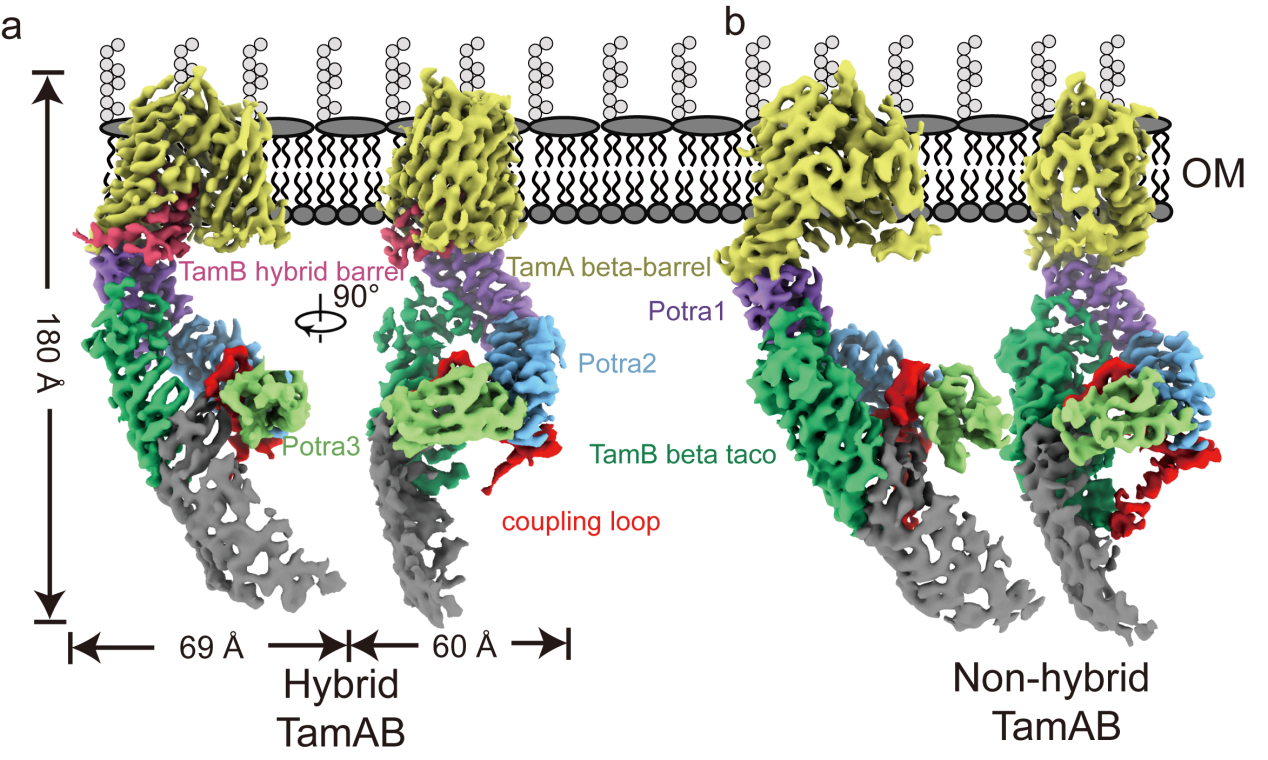
本研究利用单颗粒冷冻电镜技术,成功解析了TamAB复合物在两种不同构象下的三维结构,分辨率分别达到3.69 Å和3.82 Å。结构分析揭示了一个独特的“杂合桶(hybrid barrel)”结构,该结构由TamA桶状结构的第一条β-链与折叠在β-桶内部的TamB C末端结构域的最后一条β-链共同形成。
通过将结构分析与生化实验、功能数据及分子动力学模拟相结合,研究团队鉴定出了参与TamAB相互作用的关键氨基酸残基,并详细表征了磷脂在TamB连续β-螺旋疏水空腔内进行转运的分子机制。
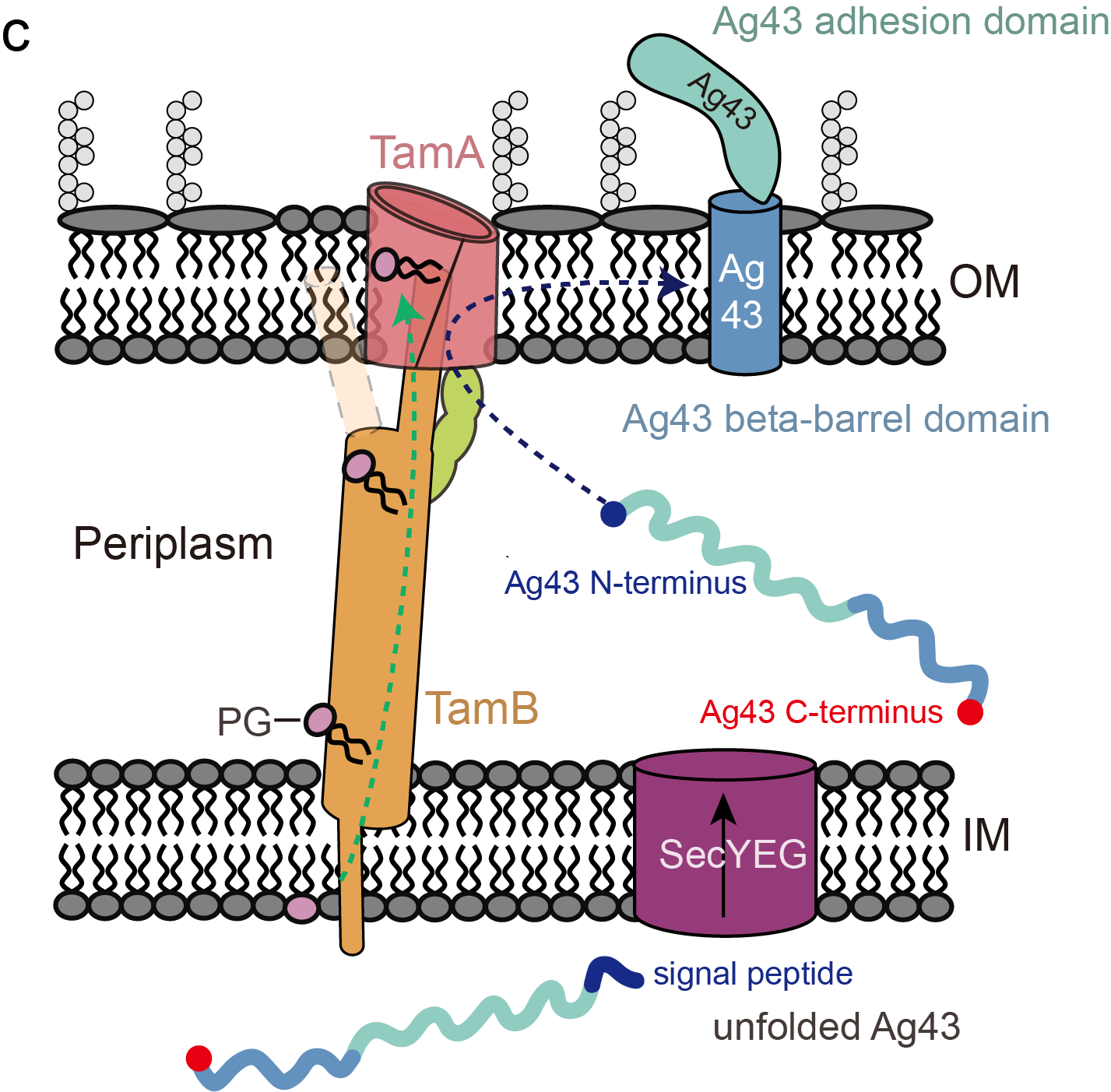
此外,研究团队通过二硫键交联和功能实验,揭示了TamA不仅与TamB存在相互作用,还与自身转运蛋白Ag43存在交联。研究还证实了冷冻电镜下观察到的两种TamAB构象状态在体内是真实存在的。值得注意的是,尽管BAM复合物的过表达可以弥补TamAB缺失导致的Ag43插入缺陷,但它无法挽救磷脂转运功能的丧失,这进一步区分了两者在细胞包被生物发生中的独特功能。
鉴于TamA和TamB的同源物在细菌和真核生物中广泛分布,该研究发现不仅对理解细胞包被的生物发生具有广泛的生物学意义,更为通过抑制该通路来开发新型抗菌疗法提供了潜在的策略和方向。
致谢
武汉大学药学院董长江教授、张郑宇老师为论文通讯作者,武汉大学药学院博士研究生杨彪为论文第一作者。药学院为文章第一完成单位。该研究得到了中国国家重点研发计划(2022YFA1303500)、国家自然科学基金(项目编号:32250710142)、武汉大学战略与人才支持计划以及中央高校基础科研基金的支持。感谢武汉大学科研公共服务平台冷冻电镜机组高级工程师李丹阳和实验员李香凝的协助,感谢武汉大学科研公共服务平台周平老师的协助。
文章信息:Yang, B., Fan, R., Batista, M.B. et al. Structural basis of outer membrane biogenesis by the TamAB translocase. Nat Commun 17, 437 (2026). https://doi.org/10.1038/s41467-025-67115-7