2025年12月11日,武汉大学高帅、姚霞团队与清华大学刘磊团队合作,在《Nature Communications》上发表了题为“Structures of human glucose-6-phosphate transporter reveal reciprocal antiport mechanism driving glucose-6-phosphate and inorganic phosphate exchange”的最新研究成果。该研究通过冷冻电镜解析了人G6PT1(~46 kDa)在Apo、结合磷酸盐、结合G6P类似物等多种状态下的高分辨率结构,系统揭示了其驱动葡萄糖-6-磷酸(G6P)与无机磷酸盐(Pi)进行“一进一出”对向交换的分子机制,为理解G6PT1在代谢稳态中的作用及其在GSD1b等疾病中的功能失调提供了关键见解。

葡萄糖是生命活动的核心能源,其关键代谢中间体——葡萄糖-6-磷酸(G6P),通过葡萄糖-6-磷酸转运蛋白(G6PT1)被转运至内质网腔,转化为葡萄糖以维持血糖稳态。G6PT1功能缺陷会导致糖原贮积症Ib型(GSD1b),表现为低血糖、肝肾功能损伤等严重症状。然而,该蛋白的三维结构、底物识别与转运机制长期处于“黑箱”状态,严重阻碍了相关疾病机制研究与靶向药物开发。
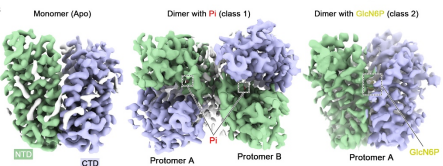
图1 人G6PT1的冷冻电镜结构测定
本研究采用单颗粒冷冻电镜和生物化学等技术手段,捕捉到人G6PT1(~46 kDa)在Apo、Pi结合态和GlcN6P结合态(一种G6P的类似物)的高分辨率冷冻电镜结构,所有这些结构均处于胞质开放构象中。结合分子对接和功能测试,这些结构阐明了G6PT1中Pi和G6P识别的分子基础。比较分析表明,Pi结合会触发一个跨域盐桥的形成,从而导致腔内门的增厚以及更紧凑的中心腔室以容纳G6P的结合。除了单体外,本研究还解析出了G6PT1二聚体的高分辨率结构。在二聚体界面处的关键残基突变会显著损害转运活性,表明蛋白质的寡聚化状态可能是其功能调控的重要手段。因此,本研究结果为理解G6PT1的工作机制及其在GSD1b病理失调中的作用提供了结构框架。
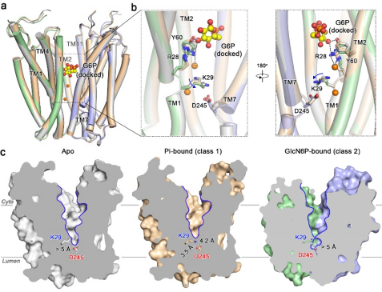
图2 底物G6P和磷酸Pi的转运模式
致谢
武汉大学药学院高帅、姚霞教授与清华大学化学系刘磊教授为论文共同通讯作者,武汉大学药学院博士生汪倩、郭宁杰、刘俊午和清华大学化学系博士生杜运祥为共同第一作者。武汉大学为文章第一完成单位。该研究得到了武汉大学泰康生命医学中心和复杂生命体代谢与调控全国重点实验室的支持,以及武汉大学科研公共服务平台冷冻电镜机组高级工程师李丹阳和实验员李香凝的协助。该研究由国家自然科学基金及中央高校基本科研业务费专项资金共同资助。
论文信息
Wang, Q., Guo, N., Du, Y. et al. Structures of human glucose-6-phosphate transporter reveal reciprocal antiport mechanism driving glucose-6-phosphate and inorganic phosphate exchange. Nat Commun (2025). https://doi.org/10.1038/s41467-025-66386-4