近日,武汉大学药学院/中南医院药学研究院许鹏飞教授联合University of Pittsburgh谢文教授团队在Nature Communications期刊上在线发表了题为“A loss-of-function human ADAR variant activates innate immune response and triggers bowel inflammation”的研究论文。该研究揭示了RNA编辑酶ADAR基因突变与炎性肠病(IBD)发生发展的直接关联,并提出了新的IBD防治新靶标。许鹏飞和谢文教授为共同通讯作者,许鹏飞教授为共同第一作者。
IBD是一种慢性反复发作的肠道炎症性疾病,主要包括克罗恩病和溃疡性结肠炎。近年来,随着饮食结构、生活方式和城市化进程的改变,IBD在我国发病率逐年升高,已成为影响公众健康的重要疾病之一。IBD病因复杂,涉及遗传、免疫、环境等多因素,其中遗传因素被认为是影响发病风险的关键因素之一。
研究团队通过对IBD数据库的人类遗传学分析,发现ADAR基因的一种错义突变(1:154574600 T/C Variant p.Asn173Ser)在IBD患者群体中显著富集,携带率约为1/126。进一步功能实验证实,该突变显著降低ADAR的RNA编辑活性,导致肠道细胞中双链RNA(dsRNA)和逆转录病毒元件(ERVs)异常积累,进而激活MDA5介导的先天免疫信号通路,引发肠道炎症反应。值得注意的是,研究团队首次发现MDA5本身是ADAR介导RNA编辑的新靶点,编辑后的MDA5蛋白活性降低,形成负反馈调节机制,防止过度免疫激活。
为验证ADAR突变在IBD中的致病作用,研究团队构建了肠道特异性ADAR敲除小鼠模型(AdariΔgut和AdariΔISC),发现肠道上皮或干细胞特异性缺失ADAR可自发诱导严重的肠炎和结肠缩短,伴随明显的免疫细胞浸润和细胞凋亡。机制上,ADAR缺失导致dsRNA积累,激活MDA5-IFNγ-JAK/STAT信号轴,诱导肠道干细胞凋亡和肠道屏障功能损伤。此外,研究团队通过肠道类器官筛选实验还发现,临床上治疗骨髓纤维化的药物JAK1/2抑制剂鲁索利替尼(Ruxolitinib)可有效缓解ADAR缺失诱导的肠道类器官死亡和小鼠肠炎症状。
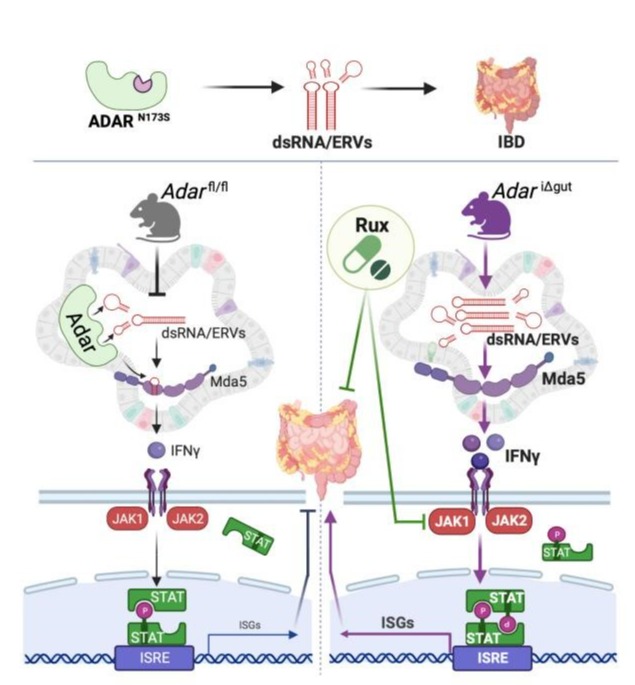
Graphical abstract: Summary of ADAR loss-of-function triggered spontaneous IBD through the intestinal ADAR-ERVs/dsRNA-MDA5-IFNγ-JAK/STAT axis. Pharmacological inhibition of JAK1/2 by Ruxolitinib attenuated IBD in Adar-deficient mice.
该研究系统阐明ADAR介导的RNA编辑修饰在维持肠道稳态和防止炎症反应中的关键作用,明确ADAR-ERVs/dsRNA-MDA5-JAK/STAT信号轴在IBD发生中的核心机制,并找到针对该机制的靶向治疗新策略,为IBD的临床防治提供新的分子靶点和理论依据。
(全文链接:https://www.nature.com/articles/s41467-025-63554-4)