近日,武汉大学药学院、中南医院药学研究院田间教授团队在国际知名期刊《Chemical Engineering Journal》(IF = 15.1,一区TOP)在线发表了可控光疗抗肿瘤方面的研究成果。该研究设计并开发了一种具有原位可切换光热/光动力治疗效果的超分子纳米囊泡,实现了肿瘤的精准可控光学治疗。
论文题目为《Supramolecular nanovesicles with in-situ switchable photothermal/photodynamic effects for precisely controllable cancer phototherapy》(《具有原位可切换光热/光动力效应的超分子纳米囊泡用于精准可控的癌症光疗》)。武汉大学药学院2018级博士生胡烈锋为第一作者,现为武汉纺织大学材料学院讲师,武汉大学药学院为论文第一署名单位和通讯作者单位。
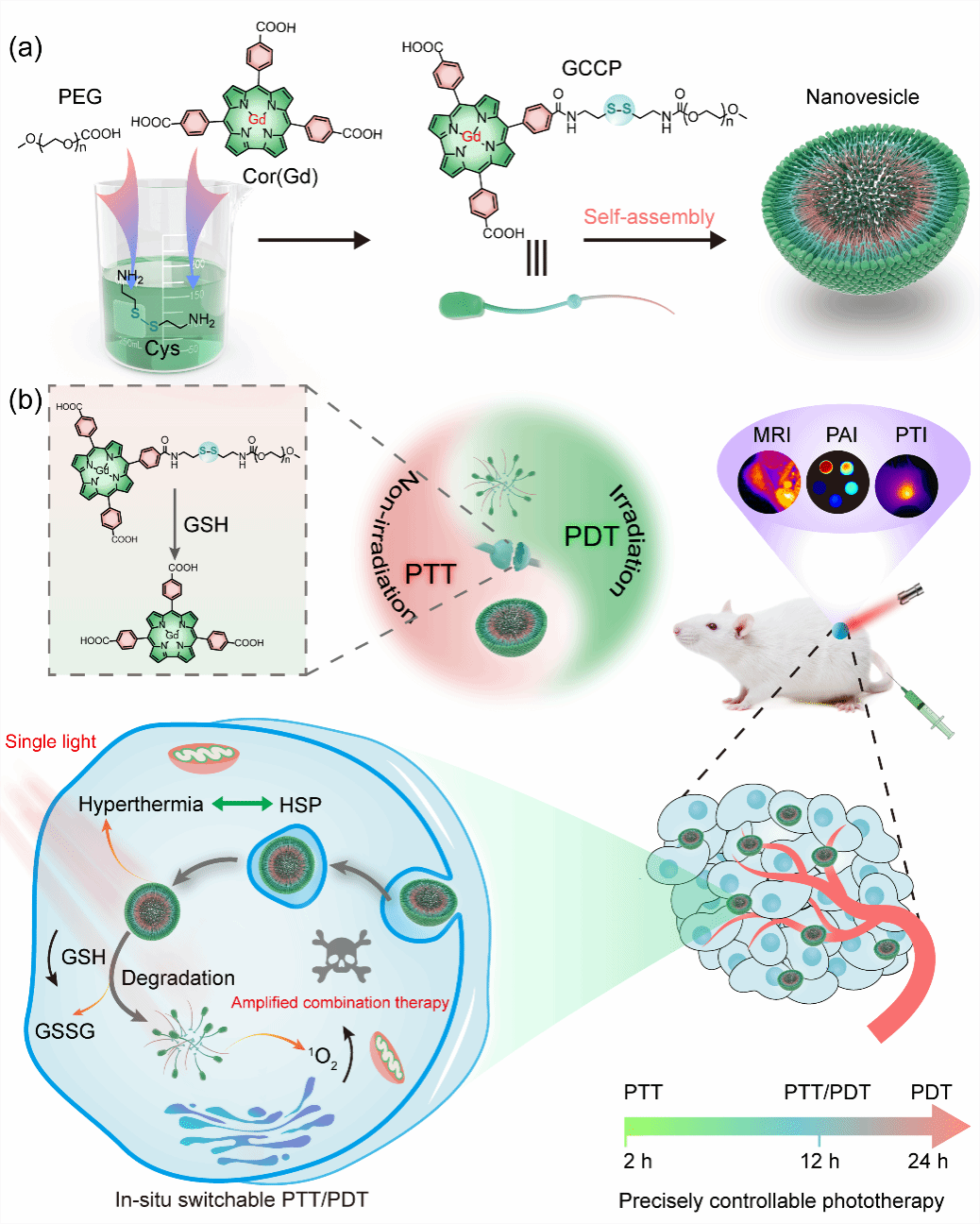
图:具有原位可切换PTT/PDT性能的超分子纳米囊泡用于精准可控的癌症光疗
光学治疗包括光动力疗法(PDT)和光热疗法(PTT),因其良好的广谱抗肿瘤作用、时空选择性和侵袭性小等优点,在肿瘤治疗中得到了广泛的关注。 然而,单一疗法的疗效常常会受到细胞内各种微环境的限制。以往的研究表明,PDT和PTT之间存在着相互促进的关系。PTT可以增加血流量,从而改善肿瘤乏氧微环境提高PDT的效率;而PDT可以消除PTT中的耐热肿瘤细胞。因此,PDT、PTT联合光疗通过协同作用增强抗肿瘤效果是一种很有前景的抗癌策略。然而,目前的联合光疗手段主要通过:(1)由两种光活性试剂组成的纳米复合物来发挥各自的光动力能力和光热效应,这种方式通常制备复杂且治疗过程漫长。(2)采用同时具有光动力和光热效应的单一光活性分子,然而其通常会受到竞争性能量消耗和在肿瘤组织中富集不足的限制。此外,肿瘤微环境(TME)中过表达的谷胱甘肽(GSH)和热疗诱导的热休克蛋白表达可显著抑制其光疗效率。因此,急需开发具有可控PDT/PTT效果的高效光活性纳米药物以增强联合光疗效果。
鉴于此,田间课题组将疏水性光敏剂分子咔咯(Cor)和亲水性分子聚乙二醇(PEG5000)通过GSH响应性的胱胺连接,以作为实现可控光疗的开关。该聚合物通过亲疏水作用自组装形成超分子纳米囊泡(nanovesicle,NV),可用于精准可控得光疗抗肿瘤。Cor是一种卟啉类化合物,由于其独特的18π共轭芳系,具有高消光系数和强烈的荧光发射。Cor的空腔也可用于螯合高价金属离子Gd3+(GCCP)以用于核磁成像。PEG链赋予了NV的水稳定性和体内长循环能力,二硫键的引入使得该NV在TME下发生GSH响应性降解,进而成为游离的光敏性Cor小分子。自组装Cor在NV中的强π-π堆积表现出55.1%的高光热转换效率,同时产生了荧光猝灭以及抑制了光动力效应。在肿瘤微环境中高表达的GSH触发NV降解后,光动力效应和荧光恢复而导致从PTT到PDT的转变。这是首次利用超分子NV通过肿瘤特异性来实现PTT到PDT的转化,从而实现精准可控的肿瘤光学治疗。体内外实验充分证实了该类超分子生物材料的可行性以及原位触发的PTT与PDT转换的可控光治疗概念,为癌症治疗提供了一种独特高效的策略。
该研究得到了国家自然科学基金和湖北省重点研发计划的资助。
文章链接:https://doi.org/10.1016/j.cej.2023.146829