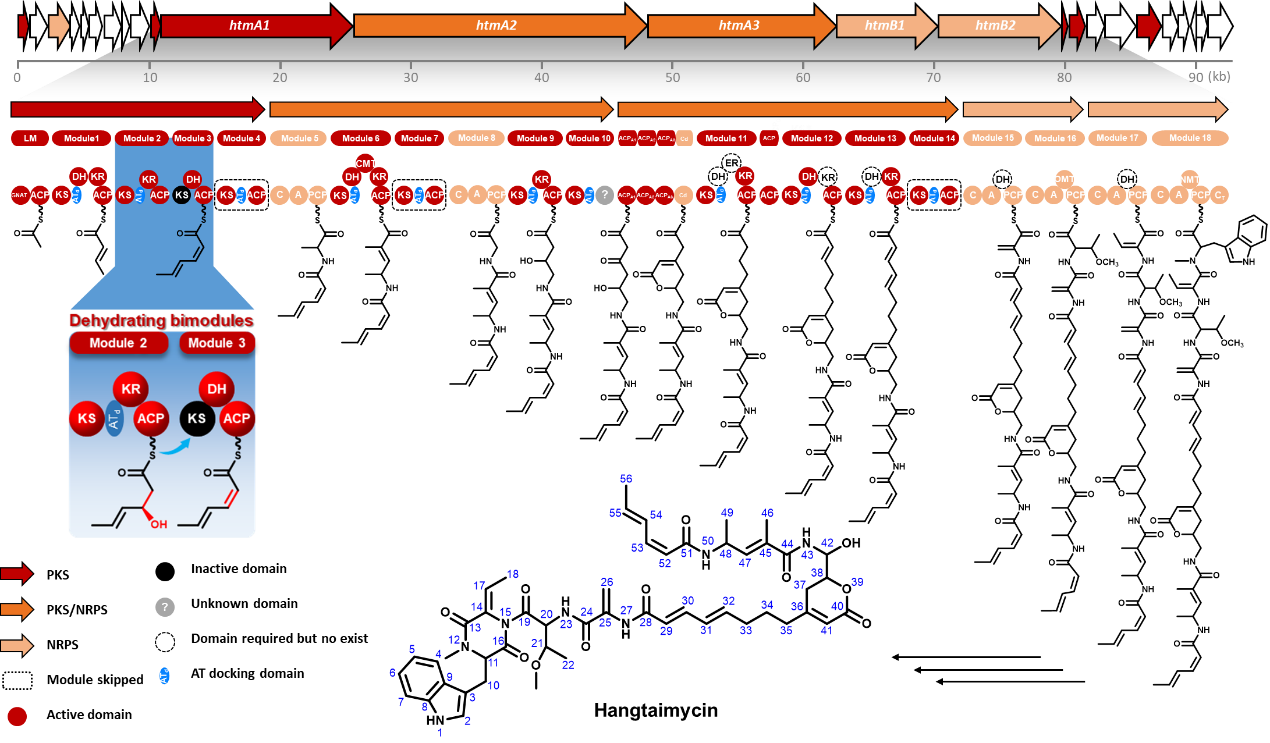
近日,《德国应用化学》(Angewandte Chemie International Edition)在线发表了武汉大学药学院孙宇辉教授课题组和德国波恩大学Jeroen S. Dickschat教授课题组在聚酮合酶(Polyketide synthase, PKS)生物合成领域最新研究进展,揭示了PKS中A型脱水双模块结构域共同催化形成Z型双键的作用机制。武汉大学为第一完成单位,药学院博士研究生罗明和和波恩大学许厚超为本论文共同第一作者,孙宇辉教授和德国波恩大学Jeroen S. Dickschat教授为共同通讯作者。此研究得到国家重点研发计划和微生物代谢国家重点实验室开放课题的支持。
肝脏是人体内以代谢功能为主的一个重要器官。而生活中许多原因都容易导致肝损伤,现代快节奏的生活也加剧了肝损伤,肝损伤后期极易发展成为肝硬化及肝癌,严重威胁人类健康。然而,目前临床抗肝损伤药物较少,开发新的抗肝损伤药物成为治疗肝损伤的需求迫切。
孙宇辉教授课题组前期在微生物活性天然产物的挖掘过程中,从武汉大学校园土壤中分离到的一株链霉菌(Streptomyces spectabilis CCTCC M2017417)中发现了一类具有抗耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus, MRSA)活性的萘安莎类抗生素曲张链丝菌素(Streptovaricins),并对参与曲张链丝菌素的多个细胞色素P450酶编码基因进行了全面探索(ACS Chemical Biology, 2017, 12: 2589-2597),揭示了与其中亚甲基双氧桥结构相关的生物合成机制(Nature Communications, 2020, 11: 4501)。在对这一菌株活性次生代谢产物的进一步挖掘过程中,重新分离获得了媲美一线抗肝损伤临床药物水飞蓟素的活性先导化合物Hangtaimycin,并纠正了其立体化学构型。通过对Hangtaimycin的结构及其生物合成基因簇生物信息学分析,发现Hangtaimycin的碳骨架化学结构与催化其生物合成的PKS结构域(Domain)功能之间存在非经典线性对应,其中HtmA1中四个模块(Module)仅负责催化两轮碳链延伸。通过与Jeroen S. Dickschat教授课题组,以及药学院沈坤副研究员、项瑾副教授团队合作,运用体内遗传失活、底物化学合成及体外生化重建等方法,证明模块1仅负责一个不饱和双键单元的延伸,模块2模块3以非典型共线性脱水双模块的方式,共同催化第二个Z型双键的形成。
在经典的I型PKS催化聚酮碳链骨架生物合成过程中,PKS模块和结构域的数量和功能与其所催化形成的相应化学结构之间存在着严格的线性对应关系,即聚酮链合成的底物选择、还原程度和产物的立体化学构型都是由PKS上相应模块中的结构域所决定,通过对酮基选择性地还原和脱水,从而在终产物的相应位置形成酮基、羟基、双键等功能团,同时还可决定产物手性中心的立体化学构型。尽管之前在PKS中已发现脱水双模块之间可以合作的方式共同催化一个双键的形成,但是本研究首次证实了这一脱水双模块的作用方式和机制。这一发现有助于进一步拓展人们对PKS经典的线性装配模式的认知,也为聚酮药物的人工创新提供新的契机和灵感。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202106250